Микробиота желудочно-кишечного тракта собак и ее модификация про-, пре- и синбиотиками
Аннотация
Интерес к составу микробиоты кишечника и возможности ее терапевтической модификации резко возрос за последнее десятилетие, и стали доступны более подробные данные о составе микробиоты разных участков слизистой оболочки желудочно-кишечного тракта собак. Пробиотики, пребиотики и их комбинация (синбиотики или симбиотики) являются способом модификации микробиоты кишечника и оказывают влияние на иммунный ответ хозяина. Пробиотики могут оказывать благотворное действие различными путями, например, продуцирование антимикробных пептидов, усиление роста благоприятных эндогенных микроорганизмов, конкуренция за место эпителиальный колонизации и иммуномодулирующие функции. Не смотря на широкое использование про-, пре- и синбиотиков, научных доказательств их положительного эффекта на собак недостаточно. Конкретные эффекты различных штаммов, их комбинаций или их потенциальные побочные эффекты оценены недостаточно. В некоторых случаях результаты in vitro были многообещающими, но не показали того же эффекта в ситуации in vivo. Специфические заболевания желудочно-кишечного тракта (ЖКТ) собак или условия, при которых пробиотики были бы полезны, их наиболее подходящая дозировка и применение не были широко изучены. В этом обзоре обобщается текущие знания о составе микробиома кишечника собак и оцениваются доказательства использования пробиотиков при различных заболеваниях ЖКТ собак. Авторы обзора хотят предоставить ветеринарным врачам информацию, основанный на доказательной базе о том, когда и почему эти препараты могут быть полезны для профилактики или лечения патологий ЖКТ собак. В нем также излагаются данные о безопасности и одобрении коммерческих пробиотических продуктов и возможное использование фекальной трансплантации микробиоты у собак, поскольку они связаны с темой использования пробиотиков.
Введение
У млекопитающих микроорганизмы встречаются в изобилии; на самом деле количество микробных клеток примерно в 10 раз больше, чем клеток хозяина (Gibson & Roberfroid 1995), содержащих примерно в 1000 раз больше микробных генов («Проект микробиома человека»). Концепция микробиома была впервые предложена Джошуа Ледербергом, который придумал термин «микробиом», чтобы «обозначить экологическое сообщество комменсальных, симбиотических и патогенных микроорганизмов, которое буквально делят с нами наше тело» (Lederberg & McCray 2001). Общепризнанно термин «микробиота» (ранее обозначаемый как «микрофлора») используется для описания бактериальных сообществ на поверхностях слизистых оболочек (с или без люминальными (внутрипросветными) микроорганизмами) или на других участках тела (например, на коже). В общем смысле термин «микробиом» в настоящее время используется для обозначения всей генетической массы («генома») микроорганизмов. В основном, но не совсем правильно, он используется для описания бактериальных геномных сообществ. Следует, вероятно, разделить «бактериом», «виром» (Mansfield 2015) или «микобиом» (Foster et al. 2013) соответственно, и использовать термин «микробиом» для всех микроорганизмов в совокупности (ten Oever & Netea 2014). Эти микроорганизмы включают эукариоты, археи, бактерии, вирусы и грибы. Живя в таком тесном контакте, они обычно не вредны для хозяина; и в большинстве случаев считаются полезными. Например, кишечная микробиота поставляет короткоцепочечные жирные кислоты (КЦЖК) в качестве питательных веществ для колоноцитов (Cummings 1981; Rérat et al. 1987; Cummings & Macfarlane 1991).
В последние годы все больше исследований было сосредоточено на характеристике микробиоты на разных участках тела у людей, что привело к реализации проекта «Микробиома человека» (The NIH HMP Working Group 2009); и был достигнут значительный прогресс в определении и понимании микробных сообществ у мелких животных, особенно при наличии методов крупномасштабного геномного секвенирования.
Естественно, обнаружение различий в характеристиках микробиоты или композиций микробиома между здоровыми и больными субъектами привело к выводу, что изменение этих микробных сообществ может оказать благотворное влияние на здоровье хозяина при определенных обстоятельствах. Именно здесь основное внимание уделяется применению пре- или пробиотиков или их комбинаций (так называемых синбиотиков (иногда используется термин симбиотики)); особенно при заболеваниях кишечника человек и собак, таких, как воспалительные заболевания кишечника (ВЗК) (Sauter et al. 2006; Ghouri et al. 2014; Rossi et al. 2014; Schmitz et al. 2014, 2015a; Saez-Lara et al. 2015).
Поскольку пробиотики обычно не относят к лекарственным средствам, им не нужно проходить какой-либо процесс, доказывающий их эффективность при применении, заболеваниях или даже у конкретных видах животных. Следовательно, было озвучено множество их медицинских преимуществ как у людей, так и у животных. В этом обзоре основное внимание уделяется тому, что известно об определении, механизме действия и эффективности пробиотиков при различных заболеваниях ЖКТ у собак, и суммируются эти данные, чтобы читатель мог лучше судить о том, когда и как использовать пробиотики в гастроэнтерологии мелких домашних животных.
Состав микробных сообществ желудочно-кишечного тракта собак
Микробиом желудочно-кишечного тракта у здоровых собак
В последнее время высокопризводительные методы секвенирования ДНК улучшили идентификацию микроорганизмов у мелких животных. В основном эти методы были применены для описания филогенетической структуры и функциональной емкости микробиома ЖКТ (Handl et al. 2011; Swanson et al. 2011; Hooda et al. 2012). Некоторые исследования включали в себя образцы слизистой оболочки или кишечного содержимого различных сегментов ЖКТ (Suchodolski et al. 2009, 2010, Suchodolski et al. 2012a), но большинство из них было сосредоточено на анализе образцов фекалий, поскольку их легче получить (Garcia-Mazcorro et al. 2011; Handl et al. 2011, 2013; Swanson et al. 2011; Suchodolski et al. 2012b; Honneffer et al. 2014; Minamoto et al. 2014a). Это важно при сравнении исследований друг с другом, поскольку было показано, что популяции бактерий различаются между различными субстратами и отделами кишечника (Momozawa et al. 2011).
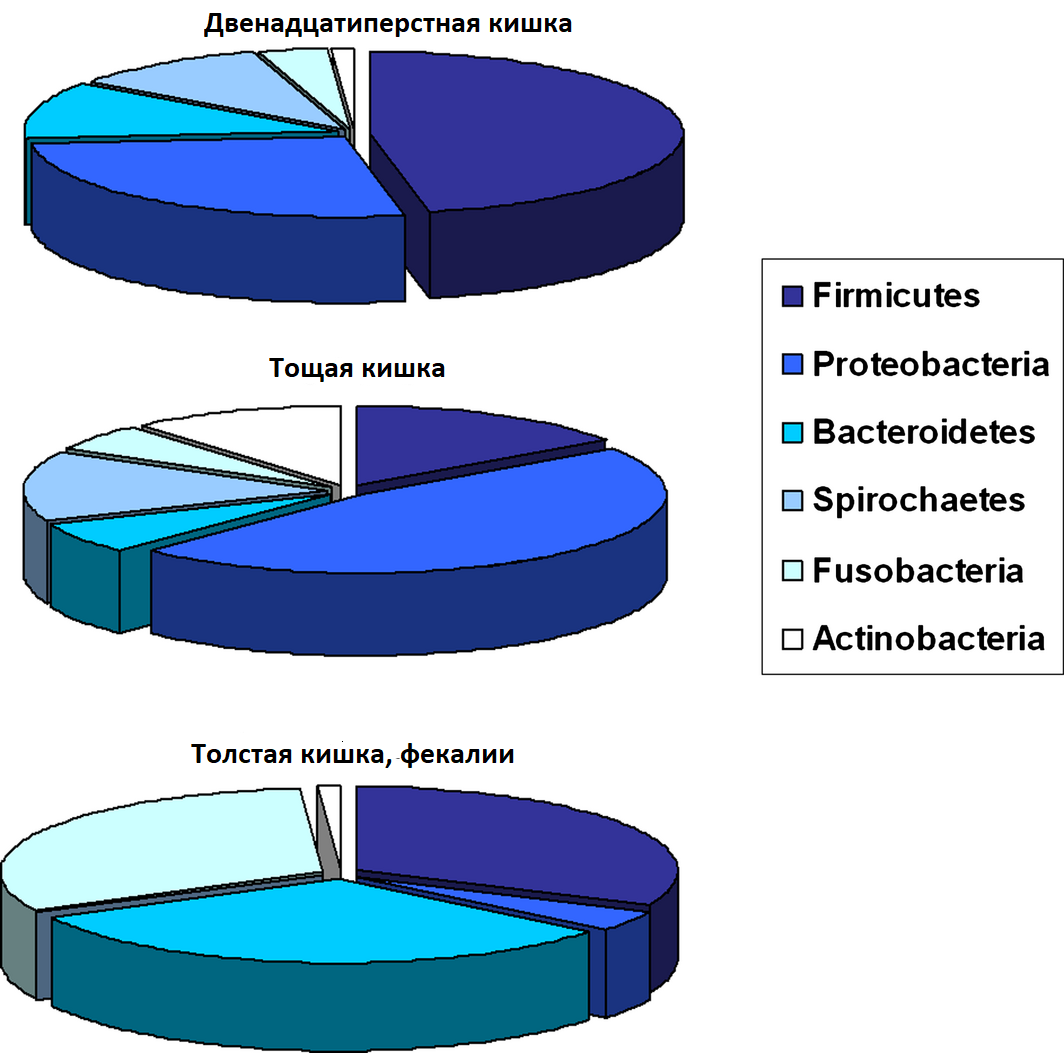
В целом, количество бактерий и их разнообразие постепенно возрастают по ЖКТ (Suchodolski et al. 2005) (Рис. 1). В здоровом желудке собак общая бактериальная нагрузка сравнительно низкая (105 log10 число копий 16S рРНК) и в основном состоит из Proteobacteria (99.6% полученных последовательностей генов) и немного Firmicutes (0,3%) (Garcia-Mazcorro et al., 2012). Преобладающими видами являются Helicobacter и Lactobacillus spp. Сообщается, что у здоровых собак микробное сообщество двенадцатиперстной кишки состоит из шести первичных типов: Firmicutes (46.4% полученных последовательностей фрагментов 16S рРНК), Proteobacteria (26.6%), Bacteroidetes (11.2%), Spirochaetes (10.3%) Fusobacteria (3.6%) и Actinobacteria (1%) (Xenoulis et al. 2008). В другом исследовании оценивали микробиоту тощей кишки здоровых собак и идентифицировали Proteobacteria как наиболее распространенные (46%), затем Firmicutes (15%), Actinobacteria (11.2), Spirochaetes (14.2), Bacteroidetes (6,2%) и Fusobacteria ( 5,4%) (Suchodolski et al., 2009) (рис.1). Образцы двенадцатиперстной и тощей кишок содержали 22% и 10% Lactobacillales соответственно (Xenoulis et al. 2008). Suchodolski et al. (2009) также идентифицировали четыре дополнительных типа в тощей кишке, о которых ранее не сообщалось у собак: Tenericutes, Cyanobacteria, Verrucomicrobia и Chloroflex, которые все присутствовали в небольшом количестве (<0.1%) (Suchodolski et al. 2009). В подвздошной кишке у здоровых собак преобладали Fusobacteria, Firmicutes и Bacteroidetes (Suchodolski et al., 2008). Это существенно отличается от состава композиции микроорганизмов двенадцатиперстной и тощей кишок, так как в подвздошной кишке преобладают Fusobacteriales (30%) и Clostridiales (22%) с кластерами Clostridium XI и XIVa. Кроме того, в отличие от образцов двенадцатиперстной и тощей кишок, содержание Lactobacillus spp. (1,4%) было значительно ниже. Являются ли эти вариации истинными качественными и количественными различиями, трудно оценить, так как некоторые из них в разных исследованиях, вероятно, связаны с различными способами экстракции ДНК, различиями в амплификационных праймерах и используемых платформах секвенирования (например, 454-пиросеквенирование или библиотеки клонов 16S рРНК). Образцы из толстой кишки показали ко-доминирующие типы Fusobacteria, Bacteroidetes и Firmicutes (около 30% каждый) у здоровых собак (Suchodolski et al. 2008). Наличие Fusobacteria (108 КОЕ / мл кишечного содержимого) также было продемонстрировано с использованием методов на основе культуры (Davis et al., 1977). Последующие распространенные типы были Clostridiales (18%), причем преобладал Clostridum кластер XIVa (50%) (Suchodolski et al., 2008). Этот кластер включает Eubacterium, Roseburia и Ruminococcus spp., которые имеют ферменты для пищевых волокон. Протеобактерии, включая E. coli-подобные организмы, присутствовали в низких пропорциях (1,4%), тогда как Lactobacillales присутствовали на уровне, сходном с тощей кишкой (10%) (Suchodolski et al. 2008). Результаты анализа фекального микробиома собак показали преобладание типов Fusobacteria (24–40%), Bacteroidetes (32–34%), Firmicutes (15–28%), Proteobacteria (5–6%) и Actinobacteria (0.8–1.4%) (Xenoulis et al. 2008; Suchodolski et al. 2009; Middelbos et al. 2010; Handl et al. 2011; Swanson et al. 2011; Garcia-Mazcorro et al. 2012) (Рис. 1).
Влияние диеты на микробную композицию желудочно-кишечного тракта собак
Не смотря на то, что в некоторых исследованиях было доказано, что введение пробиотиков / клетчатки в рацион обладает способностью влиять на микробиоту ЖКТ собак (Spears et al. 2005; Beloshapka et al. 2013; Panasevich et al. 2014), здесь есть некоторые ограничения. Во-первых, в основном использовались традиционные техники метода пластинчатого посева или ПЦР в реальном времени для количественного определения ограниченного числа бактерий (например, Lactobacillus sp., Bifidobacterium sp., Clostridia, E. coli) (Spears et al., 2005; Strompfová et al., 2012a). Во-вторых большинство исследований было проведено на здоровых собаках, что затрудняет возможность переноса этих результатов для больных собак и животных с чувствительным ЖКТ (например, у отъемышей или у гериатрических пациентов). В третьих, были проанализированы фекальные образцы, а не биопсия слизистой оболочки или содержимое кишечника (Spears et al. 2005; Verlinden et al. 2006; Hang et al. 2012; Strompfová et al. 2012b). Наконец, был введен широкий спектр пребиотических продуктов и дозировок, что затрудняет сравнение исследований. Авторы этого исследования недавно проанализировали фекальную микробиоту собак с хронической энтеропатией до и после 6 недель специальной диеты и сравнили их с фекальной микробиотой здоровых собак до и после того, как их перевели на туже диету (гидролизированная белковая диета) и не смогли обнаружить значительного влияния на микробный состав или разнообразие, связанные с изменением диеты (Schmitz et al., неопубликованные данные). Очевидно необходимо провести больше исследований влияния изменения диеты на здоровых собак и собак с заболеваниями ЖКТ с использованием методов молекулярного секвенирования.
Микробиальная композиция желудочно-кишечного тракта собак при различных заболеваниях
Вторжение и/или колонизация ЖКТ специфическими патогенами может сильно нарушить целостность кишечного эпителиального барьера (Viswanathan et al. 2009). У собак известны несколько потенциальных возбудителей заболеваний ЖКТ, включая Clostridium perfringens, Salmonella spp. и E. coli (Marks et al. 2002). Тем не менее большинство из них также являются признанными комменсалами и изолированы в сходных количествах у собак с признаками заболеваний ЖКТ и без них (Marks & Kather 2003; Unterer et al. 2014; Busch et al. 2015). Следовательно, причинно-следственная связь между этими организмами и заболеваниями ЖКТ должна интерпретироваться с осторожностью.
Неспецифические изменения микробиоты ЖКТ были расценены как ключевой фактор развития острого или хронического заболеваний ЖКТ. В нескольких исследованиях была предпринята попытка охарактеризовать фекальную микробную композицию у собак с диареей. При острой диарее наблюдались значительные изменения, как культуры, так и при секвенировании. Они включали в себя увеличение численности Clostridium spp. (особенно C. perfringens), E. coli, Lactobacillus и Enterococcus spp., с одновременным сокращением тех бактериальных групп, которые составляют основную часть нормальной микробиоты кишечника, таких, как Faecalibacterium, Ruminococcaceae и Blautia spp. (Bell et al., 2008; Minamoto et al., 2014b, Guard et al., 2015). При хронической диарее были обнаружены значительно более высокие показатели Bacteroides sp. при помощи флуоресцентной гибридизации in situ (Jia et al., 2010). В исследовании большой группы собак с хронической диареей с использованием ПЦР в реальном времени, у больных собак были значительно снижены количество Fusobacteria, Ruminococcaceae, Blautia spp. и Faecalibacterium spp. и значительно увеличилось количество Bifidobacterium spp., Lactobacillus spp. и E. coli по сравнению со здоровыми собаками (Minamoto et al. 2014b).
В образцах у собак с ВЗК были обнаружены изменения микробиома, подобные тем, которые наблюдались у людей с ВЗК, Значительно уменьшено видовое богатство и более высокая доля Enterobacteriaceae наблюдались в образцах из двенадцатиперстной кишки у собак с ВЗК по сравнению со здоровыми собаками (Xenoulis et al. 2008). Кроме того, в биопсии слизистой оболочки двенадцатиперстной кишки у собак с ВЗК было обнаружено более высокое содержание Proteobacteria и меньшее количество Clostridia по сравнению со здоровыми собаками (Suchodolski et al. 2010) (Рис. 2). Анализ образцов фекалий у собак с ВЗК выявил дисбактериоз, со значительно более низким бактериальным разнообразием, увеличением количества Gammaproteobacteria (i.e. E. coli) и снижением количества Erysipelotrichia, Clostridia и Bacteroidia (Minamoto et al. 2014a,b).
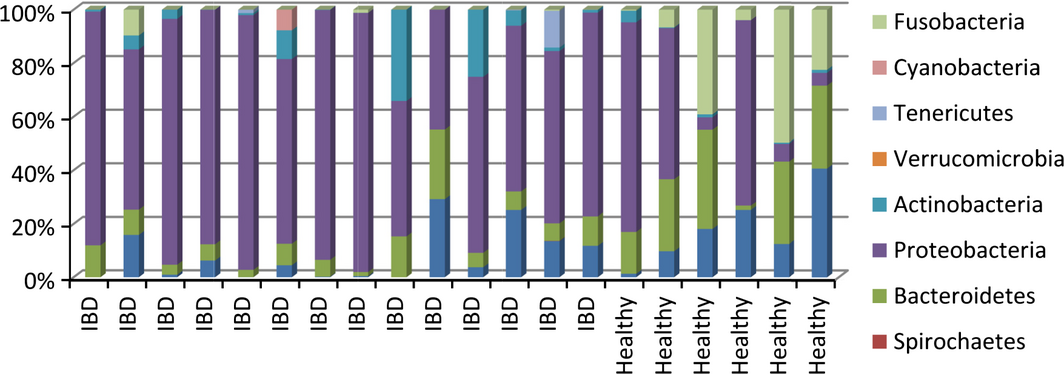
Рис. 2. Распределение бактериальных типов в двенадцатиперстной кишке 14 собак с ВЗК и 6 здоровых собак (на основе: Suchodolski et al., 2012a, b).
Являются ли эти изменения частично причиной или результатом аберрантных иммунных реакций, наблюдаемых в ЖКТ при ВЗК, остается предметом дебатов. Однако в настоящее время подозревается, что эти бактериальные изменения связаны с измененными метаболическими функциями микробиоты (например, снижение концентрации КЦЖК, изменение метаболизма аминокислот, изменения в окислительно-восстановительном балансе, изменение метаболизма желчных кислот) и, следовательно, потенциально усугубляют воспалительное состояние (Hall 2011; Minamoto et al. 2014a; Guard et al. 2015).
Определение пробиотиков, пребиотиков и синбиотиков
Пробиотики чаще всего определяются как живые микроорганизмы, которые при употреблении в достаточных количествах приносят пользу здоровью организма-хозяина (FAO/WHO, 2002). Однако во многих случаях их польза для здоровья не подтверждается строго для конкретного заболевания, применения или организма-хозяина, но термин пробиотики все еще используется. Было бы более уместным описать пробиотики для мелких животных как живые микроорганизмы, даваемые с целью улучшения здоровья организма. Они включают экзогенные и облигатные виды бактерий, которые взаимодействуют с различными клеточными компонентами внутри хозяина (см. ниже).
Пребиотики определяются как селективно ферментированные ингредиенты, которые приводят к специфическим изменениям в составе и / или активности микробиоты ЖКТ, что также является преимуществом для организма-хозяина (Gibson et al. 2010; Roberfroid et al. 2010). Обычно пробиотики представляют собой волокнистые соединения разной длины, которые проходят непереваренными через ЖКТ. К ним относятся дисахариды (лактулоза, тагатоза), олиго- или полисахариды (фруктоолигосахариды (ФОС), маннановые олигосахариды (МОС), полидекстроза, галактоолигосахариды) или длинноцепочечные пребиотики, такие, как инулин (Hughes & Rowland 2001; Ogué-Bon et al. 2010; Roberfroid et al. 2010; Koh et al. 2013).
Наконец, синбиотики (иногда употребляется термин симбиотики) — это препараты, сочетающие как пробиотики, так и пребиотики. Эта концепция была впервые введена как «смесь пробиотиков и пребиотиков, которые благотворно влияют на организм хозяина путем улучшения выживаемости и имплантации живых микробных пищевых добавок в ЖКТ путем выборочного стимулирования роста и / или активирования метаболизма одной или ограниченного количества видов бактерий, способствующих укреплению здоровья, что улучшает благополучие хозяина» (Gibson & Roberfroid 1995). Продовольственная и сельскохозяйственная организация Объединенных наций (FAO) рекомендует использовать термин «синбиотик» только в том случае, если чистая польза для здоровья будет синергической.
Механизм действия пробиотиков
Пробиотики могут улучшать здоровье слизистой оболочки несколькими предложенными механизмами, включая вытеснение кишечных патогенов (Lee et al. 2003), производство противомикробных веществ (Jones & Versalovic 2009), усиление иммунных реакций (Pagnini et al. 2010), и / или повышение-регулирование различных метаболитов (Soo et al. 2008).
Пробиотики могут конкурировать с потенциальными патогенами, препятствуя их прикреплению к слизистой оболочке кишечника или индукции продуцирования слизи / муцина (Collado et al. 2007a). Считаются, что эти механизмы специфичны штамму, причем некоторые штаммы обладают повышенной способностью к прикреплению (например, L. rhamnosus GG = LGG), а некоторые штаммы способны повышать прикрепление патогенов к слизистой оболочке кишечника (Collado et al. 2007b). Кроме того, пробиотические бактерии могут продуцировать различные противомикробные вещества, например, жирные кислоты, молочную кислоту и уксусную кислоту (Saarela et al., 2000). Некоторые Lactobacillus spp. могут снижать экспрессию генов токсинов и их продукцию у Salmonella, E.coli или C. perfringens in vitro (Medellin-Peña et al. 2007; Allaart et al. 2011; Bayoumi & Griffiths 2012) или инактивировать токсины путем продуцирования протеаз ex vivo (Castagliuolo et al. 1999). Иммунная модуляция организма-хозяина — особенно эпителиальных клеток кишечника (ЭКК) — может возникать через компоненты микробной клеточной стенки, их метаболиты или ДНК (Oelschlaeger 2010; Thomas & Versalovic 2010). Эффекты (опять-таки в основном демонстрируемые in vitro, но также и на некоторых моделях животных с воспалением) включают поддержание и укрепление плотных соединений, продления жизни ЭЭК и индукцию образования IgA и β-дефензина (Oelschlaeger 2010; Thomas & Versalovic 2010).
Интактные жизнеспособные бактерии могут быть существенными для пробиотических эффектов, или эти эффекты могут быть опосредованны компонентом клеточной стенки или структурно разнообразными секретируемыми молекулами, например, пептидами, липопептидами, липополисахаридами (ЛПС), ДНК, РНК (Lauková et al. 2004). Несколько механистических исследований показывают, что ключевыми биологическими сигнальными путями, такими как транскрипционный фактор NF-κB, митоген-активируемая протеинкиназа, фосфоинозитид-3-киназа и гамма-рецепторы, активируемые пероксисомным пролифератором для пробиотиков или их продуктов как in vitro, так и in vivo (Thomas & Versalovic 2010) (рис.3). Эти пути могут быть модифицированы по-разному с помощью отдельных пробиотических штаммов. Это исключительно специфический для штамма эффект, так как даже бактериальные штаммы одного и того же вида могут давать различные клеточные ответы. Например, Lactobacillus reuteri ATCC PTA 6475 может ингибировать LPS-индуцированную продукцию альфа-фактора некроза опухолей из миелоидных клеток in vitro путем подавления белка-активатора 1, тогда как другой штамм L. reuteri DSM 17938 не ингибирует LPS-индуцированную продукцию альфа-фактора некроза опухолей (Lin et al. 2009). Подробные сведения о клеточных взаимодействиях конкретных пробиотических штаммов были обобщены в нескольких обзорах (Oelschlaeger 2010, Thomas & Versalovic 2010, Fijan 2014, Vitetta et al., 2014) (рисунок 3).
Эффекты пробиотиков на состояние кишечника и общее состояние здоровья в основном изучались у людей и моделей грызунов для заболеваний людей (Culligan et al. 2009); гораздо более ограниченные данные доступны для видов животных, характерных для практики ветеринарных врачей (Callaway et al. 2008). Хотя пробиотики и пребиотики вводятся собакам очень часто, лишь немногие исследования оценивают сложное взаимодействие пробиотиков с клетками животных-хозяев, иммунной функцией или их влиянием на микробную композицию кишечника (Garcia-Mazcorro et al. 2011). Большинство из этих исследований in vivo у собак были довольно грубыми экспериментами ex vivo (Sauter et al. 2005; Schmitz et al. 2013, 2014). Корме того, большинство исследований для животных-компаньонов, изучали только эффекты выбранных пробиотических штаммов или пробиотических смесей на микробиоме или других эффектах-мишенях, например, цитокинах (Sauter et al. 2005; Schmitz et al. 2013, 2014).
Микробиологические продукты, используемые в качестве пробиотиков у собак в Европе
На сегодняшний день Европейским агентством по безопасности продуктов питания (EFSA) было проверено 4 бактериальных штамма / продукта, которые были безопасны и эффективны в качестве пробиотиков или кормовых добавок у собак. Они включали два штамма Enterococcus faecium (E. faecium NCIMB 10415 E1705, E. faecium NCIMB 10415 E1707), Lactobacillus acidophilus DSM 13241 25 и Bifidobacterium sp. animalis.
Оба продукта, содержащие штамм E. faecium уже были одобрены для использования на сельскохозяйственных животных в то время, когда был сделан запрос на утверждение для мелких животных (2004 г). Для одного из этих штаммов заключение EFSA состояло в том, что было предоставлено достаточное количество информации, чтобы считать его безопасным для использования у собак и для людей, имеющими контакт с обработанными собаками (E. faecium NCIMB 10415 E1707). Также считается маловероятно, что другой штамм E. faecium NCIMB 10415 E1705 представляет опасность для целевых видов даже при передозировке. Было показано, что это не способствует росту и выделению гемолитической и негемолитической E.coli у собак (и кошек).
Для продукта, содержащего Lactobacillus acidophilus DSM 13241 25 EFSA не устанавливало безопасность, поскольку штамм был чувствителен к антибиотикам, за исключением ципрофлоксацина. Поскольку никаких данных о влиянии этого пробиотика на выведение кишечных патогенов у собак не было, и он считался потенциальным респираторным сенсибилизатором, EFSA были запрошены дополнительные данные до достижения окончательного заключения.
Последним оцененным штаммом был Bifidobacterium animalis (2012). Для этого штамма (без дополнительных обозначений или деталей) требования по оценке резистентности к антибиотикам не выполнялись (поскольку штамм был устойчив к клиндамицину, и генетическая основа резистентности не могла быть установлена). Основываясь на двух представленных исследованиях, считалось, что влияние B. animalis на параметры, связанные с ЖКТ у собак, имеет сомнительную биологическую значимость, и EFSA не смогла завершить оценку эффективности этого продукта.
Помимо указанных штаммов в Европе и США в качестве пищевых добавок доступны другие пробиотики и синбиотики. Несмотря на то, что большинство продуктов, доступных в Европе на сегодняшний день, содержат штамм E. faecium NCIMB 10415 E1707, иногда в сочетании с другими бактериальными штаммами и различными пребиотиками, сами продукты в основном не были специально одобрены или протестированы. С другой стороны, E. faecium NCIMB 10415 E1707 наиболее широко используется в экспериментальных условиях, чтобы оценить влияние на иммунную функцию или здоровье кишечника (см. ниже). Другие бактериальные штаммы, доступные как безрецептурные добавки для собак, содержат различные штаммы Lactobacilli (L. acidophilus, L. casei, L. plantarum, L. paracasei, L. lactis, L. rhamnosus, L. salivarius), Bifidobacteria (B. infantis, B. lactis, B. longum, B. bifidum), Bacillus subtilis или coagulans, а в некоторых случаях дрожжи (Saccharomyces cerevisiae) или другие грибы (Aspergillus oryzae). Однако имеются ограниченные данные о безопасности и эффективности этих микроорганизмов / продуктов или связанных с ними заявление о полезности для здоровья. Некоторые микроорганизмы, отличные от E. faecium, были испытаны в качестве пробиотиков в экспериментальных условиях у собак. Например, Saccharomyces boulardii был исследован в небольшом пилотном исследовании, и выводы были озвучены на конгрессе, у собак с ВЗК и энтеропатией с потерей белка (Bresciani et al., 2014). Он значительно улучшил показатель клинической активности и уровень сывороточного альбумина по сравнению с собаками в контрольной плацебо-группе (Bresciani et al., 2014). Помимо одиночных бактериальных штаммов, протестированных in vitro (подробно ниже), некоторые пробиотические продукты с одним и несколькими штаммами также были в определенной степени испытаны в клинических условиях у собак. Большинство исследований с одним штаммом ограничились использованием E. faecium (Swanson et al., 2002; Sauter et al., 2006; Strompfová et al., 2006; Schmitz et al., 2015a). Несколько пробиотических коктейлей использовались с переменным эффектом. Например, смесь лактобацилл, которая показала многообещающие результаты ex vivo в отношении создания более толерантной микросреды в кишечнике, не значительно улучшала исход при введении в клиническом исследовании (Sauter et al., 2006). В другом исследовании штаммы из продукта, одобренного для использования у людей (VSL#3), были введены собакам с ВЗК, что привело к некоторому клиническому и иммунологическому улучшению (Rossi et al., 2014). Он включал четыре лактобациллы (L. acidophilus, L. plantarum, L. paracasei, L. delbrueckii ssp. Bulgaricus), три бифидобактерии (B. breve, B. longum, B. infantis) и Streptococcus thermophilus.
Тестирование микробных штаммов для их квалификации как пробиотиков у собак
Ряд бактериальных штаммов, преимущественно бактерий, продуцирующих молочную кислоту, выделенные из фекалий собак, некоторые из которых первоначально использовались у других видов или людей, были протестированы на предмет их пробиотического потенциала in vitro (но в настоящее время они недоступны в коммерческих продуктах). Исследования особенно сфокусированы на свойствах выживания этих штаммов при низком рН (для имитации прохождения желудка), противостоянию деградации желчными кислотами в тонком кишечнике, их адгезионным свойствам к слизистой оболочке кишечника и их потенциалу либо продуцировать противомикробные пептиды, либо ингибируют in vitro рост патогенов (в основном E. coli и Salmonella ssp.). Также были оценены некоторые другие функциональные и генетические свойства (например, ферментация углеводов, иммуномодулирующие эффекты). Эти исследования и их основные результаты обобщены в таблице 1.
Таблица 1. Список бактериальных штаммов, выделенных из субстратов собак, протестированных ex vivo на пробиотические свойства
| Бактериальный штамм | Источник | Тестирован на | Результат | Ссылка |
| Butyrivibrio fibrisolvens | Фекалии собак | Наличие и производство бутиратов | B. fibrisolvens был обнаружен на низких уровнях (2,4 × 103-9 × 105 / г сухого веса) в каловых фекалиях и отвечал только за <30% производства бутирата смешанными фекальными микробами. Введение B. fibrisolvens в больших дозах может увеличить производство бутирата и лактата | Asanuma et al. (2001) |
| L. fermentum, L. mucosae, L. rhamnosus, L. salivarius, Weissella confusa L. fermentum, L. mucosae, L. rhamnosus, L. salivarius, Weissella confusa | Фекалии собак | МИК 14 антибиотиков, жизнеспособность при рН 2 в течение 4 ч, противомикробная активность против Micrococcus luteus | L. salivarius и W. confusa являются возможными пробиотиками | Beasley et al. (2006) |
| 16 изолятов Bifidobacterium animalis ssp. lactis | Фекалии собак | Выживают в анализе на переваримость in vitro, жизнеспособны при низком pH и желчных солях, активное автоагрегирование | Все штаммы показали хорошие свойства в качестве потенциальных пробиотиков | Bunešová et al. (2012) |
| L. fermentum, L. plantarum, L. rhamnosus и их комбинация | Неясно, но утверждается, что «собакоспецифичны» | Адгезия к слизистой собак, рост на разных средах (лабораторные и производственные), методы инактивации (80° C, 95° C и УФ-облучение) | Лучшая адгезия в лабораторных условиях, инактивация нагревом снижает адгезионные свойства | Grześkowiak et al. (2013) |
| Лактобациллы, бифидобактерии и энтерококки | Содержимое толстого кишечника собак | Частота выделения, сходство с известными последовательностями генов | Молочнокислые бактерии часто встречаются в каловых фекалиях: 78% Lactobacillus, 11,6% Enterococcus, 6,8% Bifidobacterium, 2% Streptococcus bovis | Kim & Adachi (2007) |
| Энтерококки | Фекалии собак и корм для собак | Адгезия к собачьей, свиной и человеческой слизистой | E. faecium и E. faecalis проявляют штамм-зависимую адгезию in vitro к слизистой оболочке человека, собаки и свиньи без специфичности хозяина | Lauková et al. (2008) |
| Энтерококки | 28 различных коммерческих кормов для собак | Идентификация видов, профили чувствительности к антибиотикам, адгезия к слизистой оболочке человека и собак, выработка молочной кислоты, жизнеспособность в желчи | 22 отобранных штаммов классифицированы: 6 E. faecium, 4 E. faecalis, 1 E. hirae, остальные не классифицированы. Хорошие качества как пробиотика без значительной устойчивости к антибиотикам | Lauková et al. (2004) |
| Лактобактерии | Собачье молоко | Культурная характеристика лактобацилл (ферментация углеводов, производство антимикробных пептидов, адгезия к муцину, ВПК к антибиотикам) | Некоторые штаммы Lactobacillus sp. показали потенциал как пробиотики | Martín et al. (2010) |
| Лактобактерии | Фекалии собак | Резистентность к желчи, ингибирование Salmonella typhimurium, продуцирование реалеина | L. reuteri был доминирующим видом, был более устойчив к желчи, продуцировал реутерин, ингибировал Salmonella лучше, чем L. acidophilus | McCoy & Gilliland (2007) |
| Lactobacilli, Bifidobacteria | Микрофлора слизистой оболочки кишечника собак (посмертная) | Чувствительность к pH, резистентность к желчи, ингибирование патогенов, прикрепление к эпителиальным клеткам, выживаемость после лиофилизации, тест кормлением B. animalis AHC7 | B. animals AHC7 показали лучшие свойства из 62 штаммов выделенных молочнокислых бактерий. Это также уменьшило перевозку Clostridium difficile у собак | O’Mahony et al. (2009) |
| Лактобактерии | Фекалии собак | РН-чувствительность, устойчивость к желчи, ингибирование роста E.coli и Clostridium perfringens | Некоторые изоляты могут колонизировать и сохраняться в ЖКТ и вызывать положительные эффекты у хозяина | Perelmuter et al. (2008) |
| Лактобактерии | Фекалии собак | Введение in vivo Lactobacillus murinus | L. murinus временно сохранялся в ЖКТ собак и безопасен для введения | Perelmuter et al. (2011) |
| Lactobacillus acidophilus, Candida utilis, обогащенные селеном и цинком | Неизвестно | Концентрация селена и цинка в крови, антиоксидантная способность крови, состав кишечной микрофлоры | Пробиотическая группа: повышенная концентрация селена и цинка в крови, повышенная активность глутатион пероксидизы, супероксид дисмутазы, общая антиоксидантная способность, увеличение количества Lactobacillus и Bifidobacterium в фекалиях | Ren et al. (2011) |
| L. rhamnosus GG, L. johnsonii, L. casei, L. bulgaris, L. pentosus | Бактериальные штаммы: неизвестные, слизистая: разные виды, включая собаку | Адгезия различной пробиотических молочнокислых бактерий к различным клеткам слизистой | Адгезионные свойства к слизистой больше зависят от штамма молочнокислых бактерий, чем от хозяина | Rinkinen et al. (2003a) |
| Молочнокислые бактерии (L. rhamnosus GG, L. pentosus, B. lactis, E. faecium) | Неизвестно, какое-то «собачье» происхождение | Ингибирование адгезии собачьих и зоонозных патогенов (S. intermedius, S. typhimurium, C. perfringens, C. jejuni) к фиксированной слизи из собачьего тощекишечного химуса | Молочнокислые бактерии от собак уменьшали адгезию C. perfringens. Ни один штамм не ингибировал адгезию S. typhimurium или S. intermedius. Обе энтерококка усиливают адгезию C. jejuni | Rinkinen et al. (2003b) |
| L. acidophilus (2 штамма), L. johnsonii в качестве пробиотического коктейля (ПК) | Образцы фекалий от здоровых собак | PH-устойчивость, способность к ферментации, анти-ETEC-активность, производство молочной кислоты / пероксида, устойчивость к антибиотикам, способность к хранению, экспрессия цитокинов в собачьих МКПК, экспрессия цитокинов в биоптатах кишечника у собак | ПК увеличил уровни IL-10 мРНК в здоровых и воспаленных тканях, особенно по сравнению с не изменяющимися уровнями TNFα, IFNγ и IL-12p40 → индукция более толерантной микросреды | Sauter et al. (2005) |
| Enterococcus faecium NCIMB 10415 E1707 | Коммерческий продукт | Производство цитокинов в биоптатах кишечника и цельной крови при совместном культивировании с помощью EF или других TLR-лигандов | Разнообразие изменений в профиле экспрессии цитокинов, зависящее от стимулятора, TNF увеличивалось в цельной крови, но уменьшалось в биоптатах, одиночные TLR-лиганды были более сильными и последовательными, чем стимуляция E. faecium | Schmitz et al. (2014) |
| Enterococcus faecium NCIMB 10415 E1707 | Коммерческий продукт | Ответы TNFα в цельной крови по сравнению с МКПК здоровых собак | E. faecium производит ответ TNFα, как правило, более сильный ответ в цельной крови, чем в МКПК | Schmitz et al. (2013) |
| Молочнокислые бактерии | Фекалии от 22 собак | Характеристика молочнокислых бактерий (Bifidobacteria и Lactobacilli) в собачьих фекалиях (ферментативная активность, устойчивость к желчи, антимикробная чувствительность, ингибирование 15 индикаторных бактерий) | Чаще всего изолируют L. murinus, B. animalis и Pediococcus acidilactici. Все штаммы ингибировали грамположительные индикаторы (лактобактерии > бифидобактерии). L. reuteri показал лучшие антимикробные свойства, устойчивость к желчи наблюдалась во всех штаммах, имелись различия в штаммах в рН-стабильности | Strompfová & Lauková (2014) |
| Лактобациллы, энтерококки | Фекалии от 10 здоровых собак | Противомикробная активность, устойчивость к желчи, свойства адгезии | 40 штаммов энтерококков и 40 штаммов лактобацилл, выделено и протестировано, некоторые демонстрируют потенциал как пробиотиков | Strompfová et al. (2004a) |
| Энтерококки | Фекалии собак | Продукция бактериоцина, устойчивость к рН и желчи, устойчивость к антибиотикам, свойства адгезии | Общее количество 3,3-7,3 log10 CFU г-1 фекалий, большинство штаммов E. faecium, все чувствительны к ванкомицину, ампициллину, пенициллину, хлорамфениколу. 33% устойчивы к эритромицину, 28% к тетрациклину. 75% показали широкий спектр ингибирования грамположительных индикаторных бактерий. Семь штаммов дополнительно тестировались: лучшие пробиотические свойства: E. faecalis EE4 и E. faecium EF01 | Strompfová et al. (2004b) |
| Lactobacillus acidophilus | Химус тощей кишки собак | Обнаружение специфического штамма L. acidophilus LAB20 с использованием ПЦР в реальном времени | LAB20 может быть обнаружен в образцах фекалий собак до 6 недель после введения, может быть кандидатом на изучение механизма его стойкости в ЖКТ собак, может быть кандидатом в пробиотики | Tang & Saris (2013) |
| Лактобактерии | Фекалии собак | Влияние различных источников углерода на производство противомикробных соединений против E.coli и S. typhimurium у 3 штаммов лактобактерий | Субстрат влияет на продукцию противомикробных соединений L. mucosae, L. acidophilus и L. reuteri в зависимости от дозы и рН | Tzortzis et al. (2004) |
| Молочнокислые бактерии | Фекалии собак | Расщепление оксалата с помощью молочнокислых бактерий, влияние различных пребиотиков (арабиногалактана, камеди, лактита, гуаровой камеди, инуина, мальтодекстрина, ФОС) на расщепление оксалата | 37 молочнокислых бактерий, среднее расщепление оксалата составляло 17,7 ± 16,6%. Эффект пребиотиков варьировал, но в целом наибольший был у гуаровой камеди. Действие молочнокислых бактерий может снизить оксалаты в кишечнике, что потенциально снижает риск абсорбции оксалата и уролитиаза | Weese et al. (2004) |
Очень мало известно о необходимых дозировке пробиотиков у мелких животных, не говоря даже о конкретных заболеваниях. Характеристики выживаемости пробиотических штаммов (особенно E. faecium) были протестированы in vitro и in vivo, т.е. при низком pH среды (имитация среды желудка), наличии желчи, прикреплении к слизистой, выделении живых бактерий с фекалиями у собак после перорального введения (Lauková et al. 2004, 2008; Strompfová et al. 2004a; Marciňáková et al. 2006). В целом не совсем ясно является ли выживаемость микроорганизмов пробиотиков необходимой для благоприятного эффекта или достаточно только их ДНК (Kant et al. 2014). Существует некоторые свидетельства того, что даже нежизнеспособные пробиотические бактерии могут вызвать иммунную модуляцию у хозяина (Zhong et al. 2012). Кроме того очень мало информации о возможных взаимодействиях штаммов в препаратах с комбинацией штаммов, хотя некоторые исследования на грызунах и людях демонстрируют синергический эффект (Baillon et al. 2004). Эффект формы (жидкость, капсула, в составе корма) или натуральные источники потенциальных пробиотиков (йогурт, сырой черный рубец, ферментированный растительный материал) в настоящее время в основном не изучен. Имеются некоторые предварительные данные о влиянии дачи сырого мяса, пребиотических волокон и экстракта клеточных стенок дрожжей на состав микробиоты фекалий (Beloshapka et al. 2013). Изменения в зависимости от источника белка (курица или говядина) были менее очевидными, но незначительные изменения в составе микробиоты наблюдались при добавлении пребиотиков (например, большее присутствие фузобактерий, более низкое содержание Faecalibacterium). Однако значимость этих наблюдаемых изменений остается неясной, тем более, что это исследования было проведено на здоровых собаках. Кроме того в большинстве исследований оценивались фекальные образцы и отмечались лишь незначительные изменения. Однако недавние исследования показывают, что пробиотические смеси (то есть VSL#3) способны индуцировать значительные изменения в пристеночной микробиоте в толстом кишечнике мышей и собак с хроническими энтеропатиями (Mar et al. 2014; White et al. 2015).
Контроль качества также является проблемой у пробиотических продуктов. Поскольку они, как правило, классифицируются как пищевые добавки, контроль качества как в случае лекарственных средств не требуется. Опять же нет большого количества данных о качестве, сроке годности и т.д. коммерчески доступных пробиотиков. В одном исследовании были оценены микробные компоненты корма для собак, которые, как утверждается, содержит пробиотики (Weese & Arroyo 2003). Ни одна из 19 коммерческих диет не содержала всех заявленных микроорганизмов, тогда как один или несколько перечисленных компонентов можно было выделить из примерно 50% образцов. Одиннадцать образцов содержали дополнительные, связанные организмы и более 25% тестируемых диет не показали соответствующего бактериального роста. По мнению авторов, ни одно опубликованное исследование пока не оценило, соответствует ли заявляемое количество и качество бактерий в пробиотических пищевых добавках заявкам на этикетке.
Эффект пробиотиков на отдельные параметры у здоровых собак
Enterococcus faecium
Интересно, что хотя E. faecium является наиболее широко используемым пробиотическим штаммом у мелких животных, не многие исследования сосредоточились на его безопасности или эффектах при введении здоровым собакам. В исследовании, проведенном в 2003 году в Nestle Purina Product Technology Centre, щенкам из разных популярных пород собак были назначены одна из двух диет после отлучения (Benyacoub et al. 2003). Одна из диет была коммерческим кормом для собак без добавок (контрольная группа), другая — тот же корм с устойчивой инкапсулированной формой E. faecium 10415 SF68 в дозе 5 × 108 КОЕ в день-1 (лечебная группа). Основными результатами были определение общего количества фекальных IgA, концентрации общего и вакциноспецифического иммуноглобулина гамма (IgG) и IgA в сыворотке, а также количественного определения подмножеств циркулирующих лимфоцитов методом проточной цитометрии. Были также оценены потребление корма, вес и обычные лабораторные параметры (развернутый анализ крови, биохимия сыворотки). В конце периода исследования (1 год) щенки, потребляющие тестовую диету, имели значительно более высокий общий уровень фекальных и сывороточных IgA (но не сывороточный IgG) по сравнению с контрольной группой. Кроме того, уровень вакциноассоциированных IgA и IgG для вируса чумы плотоядных были значительно выше у щенков, обработанных E. faecium, по сравнению с контролем с 31 недели. Все остальные параметры не различались между группами. Это исследование показало, что E. faecium может усилить специфические иммунные функции у молодых собак (Benyacoub et al. 2003), но клиническая значимость сомнительна, поскольку результаты не обязательно коррелируют с «здоровым» кишечником. В целом, доказательства, обосновывающие использование E. faecium в этих условиях, ограничены.
Во втором исследовании, посвященном влиянию E. faecium на здоровых собак, используемый штамм (E. faecium EE3) был выделен из доступного коммерческого корма для собак (Marciňáková et al. 2006). Он был введен перорально здоровым взрослым собакам разных пород и возрастов в течение 1 недели в ежедневной дозе 2-3 × 109 КОЕ-1. Культуры фекалий и образцы крови для рутинной биохимии были получены до и в конце периода лечения, а также через 1, 2 и 3 месяца после прекращения приема пробиотиков. Применение E. faecium не вызывало каких-либо клинических побочных эффектов. Штамм сохранялся в фекалиях в течение 3 месяцев после прекращения лечения (средняя концентрация 6,83 ± 0,95 log КОЕ г-1). Общая концентрация молочнокислых бактерий увеличилась, а концентрация Pseudomonas-подобные бактерии и Staphylococcus spp. снизилась в образцах фекалий, но на концентрацию E. coli не повлияло. Общий объем сывороточных липидов и белка сократился у большинства собак с лечением, при этом холестерин находился в пределах рефферентных значений у всех собак в конце периода лечения. Таким образом, это исследование показало благоприятное влияние E. faecium на здоровье собак, возможно, даже при ожирении, хотя в исследовании не изучались животные с ожирением, и положительный эффект нормализации холестерина вызывает сомнение (Marciňáková et al. 2006). Кроме того это единственное исследование, которое показало долгосрочную стойкость перорально вводимых пробиотиков у собак, отсутствовала контрольная группа, и не совсем ясно была ли выполнена идентификация штамма; поэтому результаты этого исследования должны интерпретироваться с осторожностью. Кроме того для обоих исследований следует поставить под сомнение, если определение пробиотиков было выполнено с применением E. faecium как соответствующего преимущества повышения фекального IgA, повышения вакцин-ассоциированного титра или «понижение» холестерина не были продемонстрированы.
Лактобациллы и бифидобактерии
В ряде исследований были исследованы безопасность и эффект препаратов, с единственным штаммом молочнокислых бактерий у здоровых собак. Например, эффект от введения L. acidophilus на измеримые показатели был спорным. В одном из исследований его введение (L. acidophilus DSM13241) взрослы собакам было связано с изменением гематологических и иммунологических параметров (повышение эритроцитов, гематокрита, гемоглобина, нейтрофилов, моноцитов и сывороточного IgG, снижение хрупкости эритроцитов и концентрации NO в сыворотке) сомнительной клинической значимости (Baillon et al. 2004). В другом исследовании предположительно благоприятные изменения, наблюдаемые в составе метаболитов микробиоты и фекалий, были в большей степени связаны с добавлением пребиотического ФОС, чем с самим L. acidophilus NCFM (Swanson et al. 2002).
L. fermentum был испытан на схожей группе в двух исследованиях (Strompfová et al., 2006, 2012a). Эта молочнокислая бактерия (L. fermentum AD1) была первоначально выделена из фекалий здоровой собаки (6-летний тибетский терьер) и, как было показано, обладала хорошей выживаемостью in vitro при рН 3,0 в течение 3 ч (86,8%) и в 1% желчи (75,4%), а также имело хорошие адгезионные свойства к слизистой оболочке кишечника собак и человека и отсутствие неприемлемой противомикробной резистентности (Strompfová et al., 2006). Он был перорально введен 15 здоровым собакам различных пород в дозе 3 × 109 КОЕ-1 собака в течение 7 дней. Было отмечено значительное увеличение фекальных лактобактерий, энтерококков и сывороточного общего белка, общее количество липидов и снижение уровня глюкозы в крови. В последующем исследовании штамм вводили в лиофилизированной форме здоровым собакам и, как было показано, кратковременно сохранялись в ЖКТ и повышали концентрации КЦЖК. Кроме того, также отмечалось снижение количества клостридий и грамотрицательных бактерий (колиформы, Aeromonas, Pseudomonas) в фекальной культуре (Strompfová et al., 2012a). Однако в исследовании это подразумевалось как желаемый результат, поскольку это подход, основанный на культурах, а некоторые члены Clostridia были идентифицированы как часть нормальной полезной флоры кишечника (см. выше), из этих данных трудно сделать выводы, касающиеся здоровья кишечника. Необходимы более подробные исследования для оценки того, действительно ли этот пробиотический штамм снижает число именно потенциального патогена C. perfringens, а не Clostridia вообще.
Lactobacillus animalis LA4 (выделенный из фекалий здоровой взрослой собаки) тестировали in vitro и in vivo у девяти собак (лиофилизировали, давали в течение 10 дней). На 11-й день концентрация культивируемых фекальных лактобацилл были увеличены, а энтерококков снизилась по сравнению с началом исследования, поэтому этот штамм был определен как имеющий некоторые пробиотические свойствами (Biagi et al., 2007). Однако этот вывод почти невозможно сделать, поскольку полуколичественная культура была единственным оцениваемым результатом и не было контрольной группы.
В более позднем исследовании использовался генно-инженерный штамм Lactobacillus casei (без дальнейшего обозначения штамма), способный продуцировать биологически активный колониестимулирующий гранулоцитарный фактор и исследовали его свойства в качестве пробиотика для собак (Chung et al., 2009). Его вводили в количестве 1 × 109 КОЕ в день-1 в течение 7 недель. Обработанные собаки показали увеличенное количество моноцитов, сывороточный IgA и IgG, связанные с вакциной от коронавируса собак, по сравнению с собаками, которых кормили обычным рационом без пробиотических добавок и собак, получавших немодифицированный штамм L. casei (Chung et al., 2009). Клиническая значимость этого открытия и безопасность и эффективность введения этого штамма остаются открытыми.
Различные штаммы Bifidobacterium animalis [AHC7; (Kelley et al., 2010) и неуточненный штамм, выделенный из собачьих фекалий (Strompfová & Lauková 2014)], были исследованы на сходных группах, и было обнаружено, что они не вызывают каких-либо нежелательных эффектов. Их введение здоровым собакам увеличивало количество культивируемых молочнокислых бактерий, но уменьшало количество бактерий кишечной палочки в фекалиях собак. Другие параметры фекалий и сыворотки, а также фагоцитарная активность лейкоцитов периферической крови (особенно нейтрофилов) были улучшены у обработанных собак по сравнению с контрольной группой. Эти эффекты обнаруживались через несколько недель после прекращения применения препарата (Strompfová et al., 2014), но опять же их значимость остается неясной, тем более, что используемые методы оценки иммунной функции были довольно грубыми.
Общие данные об улучшении здоровья кишечника или иммунологическом статусе у собак при использовании лактобацилл или бифидобактерий не являются убедительными, особенно в свете того факта, что неизвестно, коррелирует ли увеличение определенной бактериального типа с улучшением функции ЖКТ или более низкой частотой диарейных заболеваний.
Бациллы
Некоторые авторы считают, что бациллы являются превосходными пробиотики для молочнокислых бактерий, поскольку они могут образовывать споры и, следовательно, быть более устойчивыми к стрессу окружающей среды и низкому уровню pH (Biourge et al., 1998; Félix et al., 2010). Однако простое выживание может быть не самой важной особенностью пробиотика, и все они должны быть проверены на предмет их пользы в клинических ситуациях. В некоторых европейских странах пробиотические продукты, содержащие Bacilli, доступны в качестве пищевых добавок для людей и животных (Biourge et al., 1998). Было показано, что они оказывают благотворное влияние на выживаемость мышей, инфицированных Klebsiella pneumoniae, и на плодовитость ряда продуктивных животных (Biourge et al., 1998). Было установлено, что Bacillus CIP 5832 является устойчивым при добавлении к собачьему корму и при проведении экспериментов по расширению-экструзии и сушке. Они также смогли выжить в ЖКТ собак, однако, похоже, не задерживались, поскольку они исчезли из фекалий через 3 дня после прекращения введения (German et al., 2000). Только одно исследование показало, что Bacillus subtilis C-3102 может улучшить текстуру и запах фекалий у собак из-за снижения содержания фекального аммиака (Félix et al., 2010). Еще раз, клиническая значимость этого открытия и обоснование обозначения бацилл как «пробиотиков» в этой ситуации весьма сомнительны, и использование бацилл в качестве пробиотиков не может быть рекомендовано.
Пробиотические смеси
Смеси пробиотиков, используемые у здоровых собак, имеют переменный состав; кроме того, результаты были различными, в основном также из-за наличия различных методов оценки изменений в микробных сообществах. В одном исследовании вводили пять потенциально пробиотических штаммов молочнокислых бактерий (L. fermentum, L. salivarius, Weissella confuse, L. rhamnosus и L. mucosae) пяти биглям с постоянными фистулами в течение 7 дней (Manninen et al., 2006). Денатурирующий градиентный гель-электрофорез (DGGE) продемонстрировал, что молочнокислые бактерии модифицировали доминирующую местную тощекишечный молочнокислую микробиоту. Все штаммы не обнаруживались через 7 дней после прекращения приема, и эффекты были временными. В другом исследовании (Garcia-Mazcorro et al., 2011) семь штаммов молочнокислых бактерий (E. faecium, S. salivarus ssp. Thermophilus, B. longum, L. acidophilus, L. casei ssp. Rhamnosus, L. plantarum, L. Delbrueckii ssp. Bulgaricus) вводили 12 здоровым собакам, а фекальные микробные сообщества оценивали с использованием DGGE, библиотек генов 16S рРНК, количественного ПЦР и 16S рРНК 454-пиросеквенирования. Пробиотические виды обнаруживались у 11/12 собак во время введения продукта, но не раньше или позже. Содержание энтерококков и стрептококков spp. было значительно увеличено. Однако при пиросеквенировании не наблюдалось никаких изменений в основных бактериальных типах. Это исследование показало, что продукт хорошо переносится и не вызывает каких-либо клинических побочных эффектов. Введение продукта приводило к увеличению обилия пробиотических видов, но этого было недостаточно, чтобы вызвать значительные изменения в общей структуре микробиома (Garcia-Mazcorro et al., 2011) и, конечно же, автоматически нельзя делать вывод о пользе для здоровья.
Наконец, в плацебо-контролируемом исследовании на здоровым ездовых собаках, которым был введен синбиотик, состоящий из E. faecium SF68, Bacillus coagulans, L. acidophilus и нескольких пребиотиков (FOS, MOS) и витаминов (B3, B6), оценивались изменения композиции фекальной микробиоты с использованием количественной ПЦР и tag-encoded FLX пиросеквенирования ампликонов генов 16S рДНК (Gagné et al., 2013). Изменения в фекальном микробиоме включали рост Lactobacillaceae и повышенную концентрацию фекальных бутиратов у всех собак. Качество фекалий также улучшились по сравнению с контрольной группой через 5 недель (Gagné et al., 2013). Являются ли эти данные коррелирующими, полезными для хозяина или только случайными, остаются неясными.
Использование пробиотиков при желудочно-кишечных заболеваниях у мелких домашних животных
Инфекционная и неинфекционная острая диарея
В целом, кажется, что, возможно, есть некоторые преимущества в использовании пробиотиков (в зависимости от штамма или используемой смеси) при острых инфекционных заболеваниях ЖКТ у собак. Введение пробиотической смеси VSL#3 рандомизированным образом щенкам с подтвержденным парвовирусным энтеритом приводит к увеличению процента выживших собак (90% в группе пробиотиков против 70% в группе, не получавшей пробиотики) и более быстрое улучшение клинических показателей и числа лейкоцитов / лимфоцитов (Arslan et al., 2012). В другом исследовании наблюдалось значительное снижение количества яиц Ancylostoma у 10 собак, которым скармливали смесь молочнокислых бактерий (L. acidophilus ATCC 4536, L. plantarum ATCC 8014 и L. delbrueckii UFV H2B20) в течение 28 дней, по сравнению с контрольной группой (Coêlho et al., 2013). Аналогичные результаты не были достигнуты при лечении лямблиоза собак с помощью E. faecium SF68: после 6 недель лечения не наблюдалось различий в выделении цист, фекальных антигенов, фекального IgA или фагоцитарной активности лейкоцитов между обработанными и необработанными собаками (Simpson et al. 2009).
Другие формы острой диареи у собак, при которых вводились пробиотики, включали стресс-индуцированную (например, содержание в приюте), антибиотико-индуцированную и идиопатическую диарею. Результаты варьируют в зависимости от пробиотического штамма и популяции собак. Применение E. faecium SF68 не дало никакого эффекта на стресс-индуцированную диарею, связанную с содержанием в приюте, что частично могло быть связано с низкой распространенностью диареи в этом исследовании (Bybee et al., 2011). У собак, подвергавшихся стрессовому воздействию, качество фекалий значительно улучшилось при добавлении Bifidobacterium animalis AHC7 по сравнению с необработанной контрольной группой (Kelley et al., 2012). Тот же штамм позволил значительно сократить время до разрешения клинических признаков и количество собак, получавших метронидазол, при лечении острой идиопатической диареи (доза 2 × 1010 КОЕ день-1) (Kelley et al., 2009). Аналогичные результаты были обнаружены в исследовании при лечении острого гастроэнтерита с использованием пробиотической смеси L. acidophilus, Pediococcus acidilactici, B. subtilis, B. licheniformis и L. farciminis (Herstad et al., 2010). Время восстановления значительно сократилось (среднее значение 1,3 дня, 95% ДИ: 0,5-2,1 дня) по сравнению с контролем (в среднем 2,2 дня, 95% ДИ: 1,3-3,1 дня) со сравнительно большой дозой 4,2 × 109 КОЕ / 10 кг 3 раза в день (Herstad et al., 2010). Инактивированные бактериальные соединения как часть «энтеровакцины» также могут быть полезны при лечении рецидивирующих самоограничивающихся эпизодов диареи (например, связанных с стрессом) у собак. Один коммерческий препарат (дезактивированные целые бактерии и лизаты E.coli, Bacillus pumilus, Morganella morganii, Alcaligenes faecalis, Shigella flexneri, Bacillus subtilis, Enterococcus faecalis и Proteus vulgaris) уменьшали количество эпизодов диареи и тяжесть у пяти из шести обработанных собак (Cerquetella et al., 2012). В этом пилотном исследовании не было контрольной группы собак, поэтому точный потенциал этой инактивированной бактериальной смеси необходимо оценить путем дальнейших клинических исследований. Интересно, что введение Saccharomyces boulardii собакам с экспериментальной диареей, вызванной линкомицином, могло бы предотвратить, но не лечить это состояние (Aktas et al., 2007).
Хроническая диарея
Как и у людей, предполагается, что патогенез хронических воспалительных состояний ЖКТ у собак (например, хроническая энтеропатия / ВЗК) связан с аберрантным ответом иммунной системы на просветную или прилегающую кишечную микробиоту (Sartor 2006; Hall & German 2010). Имеются достаточные доказательства иммунной дисрегуляции, хотя точный тип воспалительной реакции и патогенеза еще не выяснен (German et al., 2000; Peters et al., 2005; Jergens et al., 2009; Schmitz et al., 2012). В нескольких исследованиях показано, что имеются также изменения микробиома кишечника, присутствующие у собак с хронической энтеропатией / ВЗК (Suchodolski et al., 2012a, b). Следовательно, было несколько попыток повлиять на состав микробиоты у этих собак, чтобы облегчить клинические признаки; частично используя пробиотики, которые уже показали, что имеют некоторые иммуномодулирующие свойства в исследованиях in vitro или ex vivo (Sauter et al., 2005, 2006; Schmitz et al., 2013, 2014). Оценивалось влияние однократной обработки E. faecium NCIMB 10415 E1707 собак с диареей, чувствительной к корму (FRD), и обнаружилось, что это не влияет на оценку клинической активности, результаты гистологии двенадцатиперстной и толстой кишки или экспрессию отдельных генов, связанных с конкретными линиями Т-хелперных лимфоцитов (Schmitz et al., 2015b). Кроме того, также не было эффекта применения E. faecium на экспрессию генов или белков воспалительных соединений (Schmitz et al., 2015b). Более перспективные результаты могут быть достигнуты за счет использования пробиотических смесей у собак с FRD: комбинация молочнокислых бактерий (L. acidophilus и L. johnsonii) уменьшала уровни дуоденального интерлейкина (IL)-10 и толстокишечного интерферона (IFNγ) мРНК и количество фекальных Enterobacteriaceae, тогда как число Lactobacillus spp. возросло. Схожие клинические улучшения были отмечены у собак, получавших коктейль молочнокислых бактерий, по сравнению с собаками, получавшими только диету (Sauter et al., 2005).
Кроме того в открытом исследовании при лечении собак с идиопатическим ВЗК сравнивалось использование пробиотической смеси VSL#3 для домашних животных (SIVOY ™, подробности выше) и применение метронидазола и преднизолона (Rossi et al., 2014). Клиническая активность, показатели гистологии двенадцатиперстной кишки и CD3 + лимфоцитов в кишечной ткани сократили восстановление в обеих группах. Тем не менее, число клеток FoxP3+ (маркер регуляторных Т-хелперных лимфоцитов [Tregs]) значительно увеличилось только у собак, получавших штаммы VSL#3. Кроме того, количество клеток трансформирующего ростового фактора бета (TGFb)+ (скорее всего, Tregs) увеличилось в обеих группах после лечения, но до большей величины у собак, обработанных пробиотиками. Наблюдалось некоторое влияние пробиотиков на экспрессию белков с плотным соединением, при этом окклюдин значительно повышался у здоровых контрольных собак и собак, получавших пробиотики по сравнению с собаками с ВЗК. Анализ микробиома, основанный на количественной ПЦР, выявил снижение численности Faecalibacterium и Turicibacter у собак с ВЗК в начале исследования с существенным увеличением Faecalibacterium, наблюдаемым у животных, получавших VSL#3 (Rossi et al., 2014). Это примечательно, так как Faecalibacterium prausnitzii рекомендуется как противовоспалительная комменсальная бактерия у людей (Miquel et al., 2013) и имеет более низкое содержание в содержимом кишечника или фекальных образцах от пациентов с ВЗК, как людей, так и собак (Suchodolski et al., 2012b; Fujimoto et al., 2013).
Дрожжи Saccharomyces boulardii были заданы собакам с хронической энтеропатией / энтеропатией с потерей белка и здоровым контрольным собакам в небольшом пилотном плацебо-контролируемом двойном слепом клиническом исследовании, упомянутом выше, при 1×109 КОЕ кг-1 дважды в день в течение 10 дней (Bresciani et al., 2014). Собаки с энтеропатией дополнительно получали стандартное медицинское лечение, состоящее из диеты, антибиотиков и / или иммунодепрессантов. S. boulardii не обнаруживалась в фекальных образцах здоровых собак до начала лечения, но присутствовала после 1 дня приема, достигнув наивысших уровней через 5 дней (10 × 107 КОЕ г-1) и перестало через 4 дня после отмены лечения. У собак с хронической энтеропатией клиническая картина значительно улучшилась, а у собак с энтеропатией с потерей белка сывороточный альбумин значительно увеличился по сравнению с плацебо. Дуоденальные эндоскопические и гистологические оценки не отличались до и после лечения у любой из собак. Исследование показало, что S. boulardii можно безопасно вводить собакам, и это может быть полезно в качестве дополнительного лечения энтеропатий (Bresciani et al., 2014). Однако, поскольку это небольшое исследование и еще не полностью опубликовано, ожидание полных результатов и дальнейшее исследование полезности S. boulardii в качестве потенциального пробиотика оправдано.
Фекальные микробные трансплантаты
Введение одноштаммных или даже многоштаммных пробиотических продуктов может иметь ограниченную способность постоянно влиять на состав микробиома кишечника, особенно учитывая тот факт, что микробиом состоит из сотен видов микробов. Исходя из предположения, что в определенных условиях требуется более сложное изменение (например, инфекция Clostridium difficile или ВЗК), предпринимались попытки переноса микробиоты кишечника от одного субъекта к другому. Это называется фекальной микробной трансплантацией (ФМТ), восстановительной терапией микробиома или фекальной бактериотерапией. В гуманной медицине ФМТ в основном используется для рецидивирующей инфекции C. difficile. Два обзора показывают, что он безопасен и эффективен у 83-92% пациентов, у которых было достигнуто полное разрешение клинических признаков (Gough et al., 2011; Guo et al., 2012). Имеются ограниченные клинические данные, оценивающие использование ФМТ для ВЗК у людей, но экспериментальные исследования показывают, что частота ответа на ФМТ при хроническом воспалении кишечника значительно ниже по сравнению с инфекцией C. difficile (Colman & Rubin 2014). Опыт применения на мелких домашних животных относительно безопасности и эффективности ФМТ является скудным и построен на отдельных описаниях. Два доклада на конгрессах сообщают о некоторых предварительных выводах по собакам. Один из них — это отчет о текущем исследовании (не опубликованном), где собаке с эозинофильным ВЗК в течение 2 лет и умеренными клиническими признаками и применением традиционной терапии была назначена ФМТ при помощи клизмы с 45-минутным временем удерживания. Консистенция фекалий улучшилась в течение 24 часов, и собака была клинически здорова на момент составления отчета (через 3 месяца после лечения). Секвенирование 16S рРНК нового поколения фекального микробиома показала, что к 2 дню после ФМТ образец фекалий содержал донорские микроорганизмы, а также увеличилось видовое богатство по сравнению с показателями до лечения (Weese 2013). В другом докладе сообщается об использовании ФМТ у 8 собак с рефрактерной, предположительно связанной с Clostridium perfringens диареей (Murphy et al., 2014). Опять же использовалась клизма (1-3 трансплантата на собаку). У всех собак было немедленное разрешение диареи, а у 6/8 собак были отрицательные показатели на последующих ПЦР-панелях для альфа-токсина C. perfringens. Как упоминалось ранее, C. perfringens может быть частью нормальной кишечной флоры у собак, поэтому остается неясным, действительно ли обнаруженный C. perfringens был причиной диареи или, скорее, частью дисбактериоза кишечника (Minamoto et al., 2014b). Если бы это было так, то еще нужно критически оценить, отношение ФМТ и клостридиоза, даже если изменения микробиома указывают на улучшение фекального дисбактериоза. Оба автора неопубликованных тезисов конференций заключают, что ФМТ следует рассматривать как вариант лечения у собак, не имеющих других терапевтических возможностей (Weese 2013; Murphy et al., 2014), и в сообществе ветеринаров растет количество доказательств его полезности. Необходимы проспективные исследования на больших когортах собак, чтобы должным образом изучить полезность ФМТ при определенных заболеваниях ЖКТ у собак.
Заключение
Микробиота на поверхностях слизистой оболочки, особенно в желудочно-кишечном тракте, у собак сложна. Состав варьируется в зависимости от локализации, и есть некоторые свидетельства того, что изменения в составе микробиоты / микробиома связаны с определенными заболеваниями. Однако анализ состава микробиоты ЖКТ и фекалий собак, его функций, производство метаболитов и иммунологических свойств далеко не завершен, хотя данные о микробиоме накапливаются. Соответственно, все знания о лучших характеристиках микробных комменсалов или пробиотиков для собак являются неоднородными, и большинство предположений об их свойствах получены из исследований у человека. Есть некоторые бактериальные штаммы, которые демонстрируют перспективность как потенциальные пробиотики, особенно молочнокислые бактерии. Однако эффекты наиболее часто используемого штамма (E. faecium) до сих пор не совсем понятны, особенно у больных собак. Нелегко сравнивать результаты различных исследований как у здоровых, так и у больных собак, так как существуют огромные различия в применяемых пробиотиках (одноштаммные, многоштаммные, по типу микроорганизмов), их дозировка, форме и частота применения. Измеренные результаты также несовместимы. В целом авторы считают, что E. faecium более подходит для острых и / или инфекционных форм диареи; поскольку есть некоторые свидетельства того, что он вызывает более про-воспалительную, а не противовоспалительную реакцию (Schmitz et al., 2014, 2015b); тогда как некоторые лактобактерии и бифидобактерии проявляют более выраженные иммуномодулирующие функции. Интригующе, особенно сочетание молочнокислых бактерий (VSL#3), используемое в медицине для профилактики рецидива язвенного колита, имеет некоторые перспективы в лечении хронических энтеропатий у собак и в создании более противовоспалительной местной среды (Rossi et al., 2014). Интересно отметить, что даже при четко определенных инфекционных заболеваниях, таких как парвовиоз или паразитарное заражение, некоторые пробиотики оказывают благотворное влияние. Механизм этого недостаточно изучен, и необходимы дальнейшие исследования. Из исследований у людей и экспериментальных данных на грызунах известно, что иммунологический исход зависит как от бактериального штамма, так и от подвида, вероятно, зависит от дозы (Weese & Anderson 2002, Evrard et al., 2011; Garcia-Mazcorro et al. 2011) — и иммунный ответ соответствующего хозяина. У людей пробиотики были отнесены к «провоспалительным» и «противовоспалительным» препаратам у некоторых авторов в зависимости от их основных свойств (Shida et al., 2011). Из-за этого необходима тщательная оценка потенциальных пробиотиков у целевых видов и болезней — возможно, как in vitro, так и in vivo — чтобы судить об их полном потенциале. Некоторые авторы даже предлагают сначала протестировать все пробиотики in vitro или в эксплантатах ткани, прежде чем выполнять исследования in vivo (Tsilingiri et al., 2012). Однако это не всегда возможно в ветеринарной медицине.
Также следует учитывать, что бактерии не всегда могут быть наиболее подходящими пробиотиками. Мы практически ничего не знаем о грибном или даже вирусном составе нормального кишечного тракта или других поверхностях слизистых оболочек у собак (Foster et al., 2013). Имеются некоторые свидетельства того, что дрожжи, такие как Saccharomyces boulardii, могут быть действительными альтернативными пробиотиками и нуждаются в более подробных исследованиях. Кроме того, новая область — это исследование метаболитов бактерий (например, индола, ацетата), которые потенциально могут служить постбиотиками.
Трансплантация фекалий является интересным вариантом лечения как острой, так и хронической диареи у собак, однако многое еще нужно понимать в отношении ее наилучшей производительности, безопасности и полезности, прежде чем ее можно будет рекомендовать в качестве обычного лечения.
Таким образом, необходимо сделать больше работы, чтобы понять сложное взаимодействие между потенциальными пробиотиками и средой их хозяина. Очень тщательное исследование механизмов действия и подробное измерение результатов поможет понять, какой пробиотик полезен при каком состоянии, и какие изменения микробиома кишечника необходимы для достижения клинической ремиссии как острых, так и хронических состояний.
Источник и ссылки: Understanding the canine intestinal microbiota and its modification by pro-, pre- and synbiotics – what is the evidence?










Насколько я вижу, вы просто перевели опубликованную на английском языке статью. Более того, вы сделали это без надлежащего разрешения авторов и оригинального журнала. Хотя я приветствую ваш интерес к обучению людей относительно здоровья собак, то как вы это делаете — неверно. На Западе это называется интеллектуальной собственностью, и ваши действия являются незаконными. Вы можете запросить разрешение, а затем перевести и опубликовать эту статью. Люди потратили годы работы и тысячи долларов на это исследование, поэтому они заслуживают справедливого обращения.
Да, это перевод научной статьи, на которую есть ссылка в конце перевода. Если вы по ней перейдете — увидите, что эту статью разрешено использовать на условиях Creative commons, что значит нужно выполнить лишь 2 условия — поставить ссылку на оригинал и не использовать в коммерческих целях.
Спасибо, читала её на английском, а потом нашла у Вас, ещё раз перечитала.
Но вопрос остается открытым — давать или не давать профилактически? Например, такой препарат. как PROTEXIN СИНБИОТИК ДС. А есть ещё наш Эмпробио… И то и другое давала своим собакам… результат Эмпробио увидела сразу, на фоне острой диареи при отравлении кормом.
Так вот, давать или не давать? Почти шекспировский вопрос…
Даже у людей не пришли к единому мнению об использовании пробиотиков. На данный момент они не входят в лечебные схемы в ветеринарии, однако, поскольку они являются БАДом и практически не имеют побочных действий, их можно использовать. Однако надо убедиться в качестве препарата (в инструкции должна быть полная информация о содержащихся бактериях, их количестве, рекомендуемых дозировках). Препаратам отечественного производства я бы не доверяла, поскольку по регламенту БАДам не нужен контроль качества. Зарубежные препараты контролируют строже, но и там есть проблемы с БАДами.